【新刊案内】中国の薬事関係法規
~改正医薬品管理法が医薬品業界に与える影響~
市場調査・コンサルティング会社の(株)シード・プランニング(本社:東京都文京区 梅田佳夫社長、以下シード・プランニング)は、このほど、中国の改正医薬品管理法が医薬品業界に与える影響について調査を行い、その結果をまとめましたのでお知らせいたします。
中国では、2019年12月に日本の医薬品医療機器等法に相当する「医薬品管理法」が改正されました。その後、医薬品登録管理法、医薬品臨床試験品質管理規範(GCP=医薬品の臨床試験の実施基準)などの法律・法規、省令が相次いで改正・施行されています。
その背景として、2017年5月に中国が医薬品規制調和国際会議(ICH)に加盟したことが挙げられます。この加盟によって、日本、米国、EU諸国の製薬企業が中国で医薬品の承認審査を申請した場合に資料が簡略化されるほか、承認審査のスピードアップも期待されます。
本書では、日本の医薬品企業にとって、最も重要な医薬品管理法をはじめ、医薬品登録管理法、医薬品管理法実施条例(草案)、GCP(医薬品の臨床試験の実施基準)などの改正法を中心に解説しています。特に日本企業が懸念している「海外治験データの受け入れ」「海外MAH(医薬品市販承認取得者制度)の国内代理人の選定」「治験データの保護」「優先承認審査制度の施行」に焦点を当て、詳しく説明しています。

http://store.seedplanning.co.jp/item/11435.html
本書の構成、市場動向、掲載例、調査概要は以下の通りです。
本書の掲載内容
本書は6章で構成。
本書の掲載例
「第1章 医薬品管理法 1.医薬品管理法の概要」に掲載の<「医薬品管理法」改正と修正の軌跡>
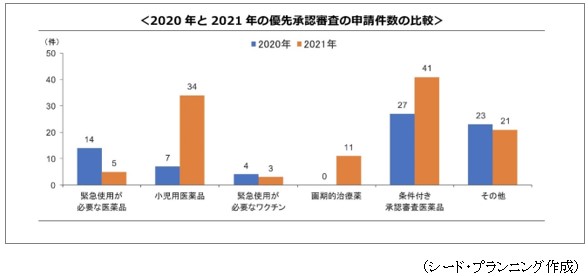
「第2章 医薬品登録管理法」に掲載の<2020年~2021年の優先承認審査の申請状況>
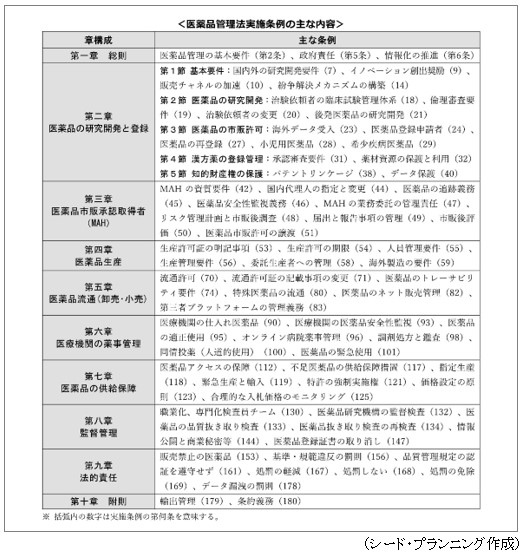
「第3章 医薬品管理法実施条例」<医薬品管理法実施条例の主な掲載内容>の掲載例
調査概要
ウェブを中心に実施。医薬品管理法をはじめとする薬事関連法規は、全国人民代表大会常務委員会(国務院)、国家衛生健康委員会、国家市場監督管理総局、国家薬品監督管理局などが公表した法律・法規・省令をもとに図表作成し、分析・解説を行った。
①医薬品管理法(概要、解説、全文翻訳、以下同)
②医薬品登録管理法 ③医薬品管理法実施条例(意見募集稿)
④医薬品臨床試験品質管理規範(GCP) ⑤医薬品生産監督管理法
⑥輸入医薬品の再登録(海外生産の医薬品再登録の申請手順・資料・形式審査
⑦MR 登録管理法 ⑧医薬品年次報告管理規定
⑨医薬品安全性監視品質管理規範 ⑩医薬品検査管理法
⑪ワクチン管理法――などの薬事関連法規。
本調査報告書においては、輸入医薬品の再登録手数料や企業の売上高などの為替レートは、1 元=20 円で換算した。
2022 年 6 月~10 月
レポート概要
中国の薬事関係法規 ~改正医薬品管理法が医薬品業界に与える影響~
2022年10月20日/A4 353ページ
書籍+PDFセット版:
PDFコーポレート版:
書籍+PDFコーポレート版:
165,000円(税込)
330,000円(税込)
363,000円(税込)
「本書の掲載内容」を参照ください。
本書の詳細とご購入は、http://store.seedplanning.co.jp/item/11435.html
本件に関するお問合せ先