ホーム > プレスリリース > 2018年 > 3月5日発表
調査結果
次世代診断・検査の市場展望 −調査結果−
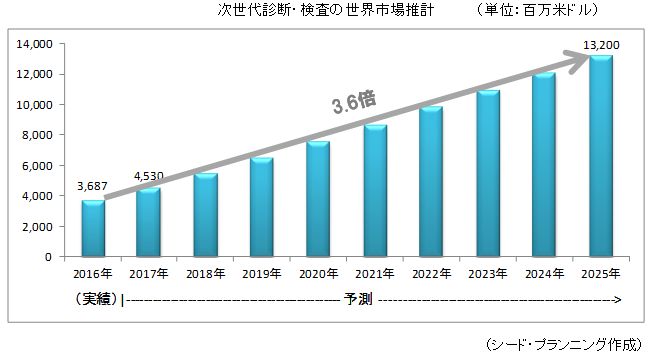
次世代診断・検査の市場は、2025年に132億米ドルになると予測
→ 2016年からの10年間で3.6倍強の市場に成長
→ 次世代診断・検査市場の中心は次世代シーケンサー
→ 特許無効による参入企業増加で競争が激化
市場調査・コンサルティング会社の株式会社シード・プランニング(本社:東京都文京区 梅田佳夫社長、以下シード・プランニング)は、世界の次世代診断・検査の開発動向と将来展望について調査を行い、このほどその結果をまとめましたのでお知らせいたします。
次世代シーケンサーや質量分析装置といった解析技術の進展とともに、生体中のゲノムやタンパク質、代謝物などを測定する新たな検査の開発が進んでいます。
がんの治療薬に関連する遺伝子変異を網羅的に解析する検査や、複数のバイオマーカーを多変量解析することで各種疾患の罹患リスクなどを数値化する検査がすでに多数開発、上市されており、これらは従来の生化学検査や免疫検査のようにシングルマーカーを基本とする臨床検査とは異なり、本書では「次世代診断/検査」として位置付けています。
早期診断や個別化医療への関心の高まりから、次世代診断/検査の開発が欧米のベンチャー企業を中心に盛んに行われており、米国をはじめとする地域で市場が急成長しています。一方で、関連規制や特許などの環境変化がビジネス展開に大きな影響を与えており、参入にあたっては企業動向も踏まえて入念な事前調査が必要です。
本調査では、次世代診断/検査の最新動向について調査するとともに、今後の市場展望について明らかにしました。
本調査結果の詳細は、市場調査レポート「2018年版 次世代診断/検査の開発動向とビジネス展望」に掲載しています。

http://store.seedplanning.co.jp/item/9934.html
調査結果のポイント、調査概要は以下の通りです。
調査結果のポイント
→ 2016年からの10年間で3.6倍強の市場に成長
→ 次世代診断・検査市場の中心は次世代シーケンサー
→ 特許無効による参入企業増加で競争が激化
次世代診断・検査の定義
本調査では、次世代診断・検査について以下のように定義している。
- 従来の免疫検査装置や遺伝子検査装置を用いたシングルマーカー検査ではなく、マルチマーカーの検査を基本とする。
- 検査技術は次世代シーケンサーやDNA マイクロアレイ、質量分析装置など臨床検査技術として近年、新しく利用されているものを主とす。
- IVD の取得有無やLDT(検査発企業の独自検査) は問わない。また、例えば体外診断薬を用いて個別に行われている遺伝子変異検査(EGFR など)は市場としてカウントしないが、次世代シーケンサーなどを用いてEGFR を含む多数の遺伝子変異等を一度に解析するサービスはカウントする。
次世代診断・検査と従来の臨床検査との違い
次世代診断・検査は従来の臨床検査とビジネスモデル以下の点で大きく異なる。
- 従来の臨床検査は、試薬・検査装置の販売が中心。次世代診断・検査は、サービス提供企業のセントラルラボでの受託検査として行わる。
- 検査価格は、従来の臨床検査は数米ドル~数十米ドル。次世代診断・検査は1,000 米ドル以上のものが大半。
- 年間検査数は、従来の臨床検査は1検査で数千万件以上行われる。次世代診断・検査では多くて数万件から30 数万件程度。
よって、次世代診断・検査は付加価値の高いビジネスであり、例えば1 つの検査でも売り上げが1 億米ドル(約100 億円)を超えるものも多数ある。検査価格は高額だが、検査にかかる原価は低いため、次世代診断・検査を提供している企業の粗利益率は製薬並みに高いケースも多く見受けられる。従来のシングルマーカーによる検査は飽和しつつあり、診断薬や検査装置は価格競争が厳しくなっている。今後はマルチマーカーの解析をベースとした付加価値の高い次世代診断・検査が伸びてくることが予測される。
2016年からの10年間で3.6倍強の市場に成長。
世界市場は、2017 年が45 億3,000 万米ドル、2025 年には132 億米ドルに達すると推計した。
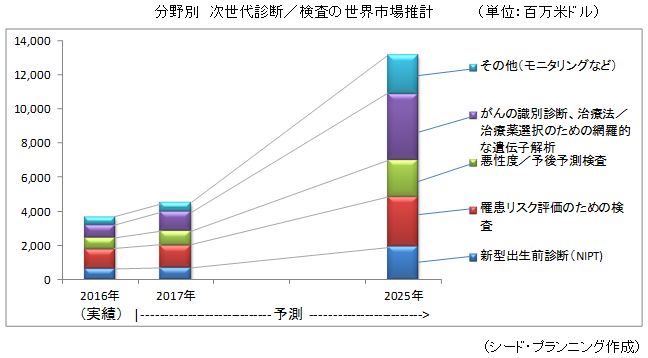
推計にあたっては、次世代診断/検査市場を以下の5分野に分類してそれぞれの市場規模を算出した。
① 新型出生前診断(NIPT)の市場
② 罹患リスク評価のための検査の市場
③ 悪性度/予後予測検査の市場
④ がんの鑑別診断、治療法/治療薬選択のための網羅的な遺伝子解析の市場
⑤ その他(モニタリングなど)の市場
なお、本書の2014 年版と比較して実績値および予測値が下方修正されているが、これは、後述する遺伝性乳がんのBRCA 遺伝子検査および新型出生前検査の特許無効判決による大幅な価格低下が影響している。
以下に分野別の市場規模(イメージ)を示す。具体的な市場規模は、市場調査レポート「2018年版 次世代診断/検査の開発動向とビジネス展望」( http://store.seedplanning.co.jp/item/9934.html )に掲載しているのでそちらをご覧いただきたい。
新型出生前診断の世界市場は、後述のSequenom の特許無効判決により価格競争が激化し、市場規模としては前回調査時に期待していたほどの伸びは見られないものの、検査精度の高まりによるNIPT 検査選択の増加、先進国/新興国における少子化/高齢出産による出生前診断の普及によって今後も市場は拡大すると予想される。
本市場は、現在、遺伝性乳がんや大腸がんを中心に行われているが、がん以外にも糖尿病や心疾患、産婦人科疾患(子癇前症、早産)などにも広がっており、予防医療に対する関心の高まりにつれ、検査も増加してくるものと思われる。 生殖細胞系列の遺伝子変異/多型検査については、2013 年に米国でMyriad の持つ特許の無効判決が米国最高裁から出されたことで(後述)、新規参入企業の増加・価格競争が激化していることから、弊社の前回調査時(2014年)に予測したほどの市場規模の拡大に繋がっていないが、今後も検査の普及・拡大により市場は伸長するとみられる。
本検査は主にがん領域で行われており、悪性度/予後を評価することで必要な患者に必要な治療を必要なタイミングで実施でき、無駄な治療や投薬を抑えることができるため、米国では医療費抑制のための手段としても利用されている。がん以外の領域では心不全、クローン病などで開発が進んでいるが、市場を考えるとがん領域以上のインパクトはない。 悪性度/予後予測のための価格について、特に乳がんを中心とした検査種類の増加による価格低下の懸念もあるが、特許で保護されているため罹患リスク評価や新型出生前診断の市場ほど大きな影響は受けないと思われる。
本市場はがん治療を行う際に主要な遺伝子変異を一気に調べる検査サービスを対象としている。米国では次世代シーケンサーを用いた網羅的遺伝子検査サービスが展開され、大きな市場を形成している。一方、日本ではこれまで各遺伝子変異を個別に解析することが中心であったが、2018 年中にパネル検査の保険償還が検討されており、今後、徐々に市場が形成されていくと見込まれる。検査価格は検査項目にもよるがおおよそ2,000〜6,000 米ドルとほかの次世代診断/検査と比較して、非常に高額である。
今後、がん遺伝子検査はバイオマーカーの個別解析から網羅的解析へ移行していくため、検査数は飛躍的に増加することが予測される。一方、次世代シーケンサーの技術進展に伴う参入企業の増加・価格競争が激化することも予測される。
分子標的薬の治療薬選択のためのパネル遺伝子検査や、新型出生前検査ではすでに次世代シーケンサーが不可欠な技術となっており、引き続き利用が拡大していくものと推測される。
さらに、がんを中心とした各種疾患において、現在病理組織により行われている検査を血液などの代替試料で行うリキッドバイオプシーの市場成長が見込まれ、次世代シーケンサーがその技術の中心になると思われる。
質量分析装置を用いてペプチドーム/プロテオームあるいはメタボロームを解析する検査や、次世代シーケンサーを用いたマイクロバイオームを解析する検査については、前回調査時(2014 年)と比較しても期待されたほど開発が進んでおらず、大きな市場を形成するに至っていない。そのため、少なくとも今後5 年以内においては、次世代診断/検査技術の中心は遺伝子解析であることに変わりないとみられる。
調査概要
- 調査方法
-
• オープンデータ収集、文献調査
• 訪問ヒアリング
• Next Generation Dx Summit 2017 での情報収集 - 調査対象
-
• 次世代診断/検査開発企業56 社
遺伝子検査を主に開発する企業
1)AC-Gen Reading Life(スペイン)
2)Agendia(オランダ)
3)Ambry Genetics(米国)
4)ArcticDx(カナダ)
5)Cancer Genetics(米国)
6)CareDx(米国)
7)Castle Biosciences(米国)
8)DiamiR(米国)
9)Epigenomics(ドイツ)
10)Exact Sciences(米国)
11)Foundation Medicine(米国)
12)Genomic Health(米国)
13)Interpace Diagnostics(米国)
14)MDxHealth(ベルギー)
15)Myriad Genetics(米国)
16)NanoString Technologies(米国)
17)Pathway Genomics(米国)
18)RiboMed Biotechnologies(米国)
19)Rosetta Genomics(イスラエル)
20)SkylineDx(オランダ)
21)Sysmex Inostics(ドイツ、シスメックスグループ)
セルフリーDNA検査を主に開発する企業
1)Ariosa Diagnostics(米国、Rocheグループ)
2)Boreal Genomics(カナダ)
3)GRAIL(米国、Illuminaグループ)
4)Guardant Health(米国)
5)LifeCodexx(ドイツ
6)Natera(米国)
7)Personal Genome Diagnostics(米国)
8)Premaitha Health(英国)
9)Sequenom(米国、LabCorpグループ)
10)Trovagene(米国)
11)Verinata Health(米国、Illuminaグループ)
ペプチドーム/プロテオーム検査を主に開発する企業
1)Applied Proteomics(米国)
2)Avant Diagnostics(米国)
3)BG Medicine(米国)
4)MyCartis(ベルギー)
5)NantHealth(米国)
6)ProteoMediX(スイス)
7)Quanterix(米国)
8)Vermillion(米国)
9)プロトセラ(日本)
メタボローム検査の開発企業
1)Biocrates Life Sciences(オーストリア)
2)Metabolomic Diagnostics(米国)
3)Metabolomic Technologies(米国)
4)Metabolomx(米国)
5)Metabolon(米国)
6)味の素(日本)
7)ヒューマン・メタボローム・テクノロジーズ(日本)
マイクロバイオーム検査の開発企業
1)Enterome(フランス)
2)Genetic Analysis(ノルウェー)
3)Map My Gut(英国)
4)Metabiomics(米国)
5)smartDNA(オーストラリア)
6)uBiome(米国)
7)Viome(米国)
8)Whole Biome(米国) - 調査期間
- 2017 年8 月〜12 月
- レポート名
- 2018年版 次世代診断/検査の開発動向とビジネス展望
- 発刊日/体裁
- 2018/1/26 A4/352ページ
- 販売価格
-
書籍版 194,000円(税込)
書籍+PDF セット版 226,800円(税込) - 目 次
-
はじめに
調査概要
総合考察第1章 次世代診断/検査について
次世代診断/検査の解析対象となるバイオマーカー/次世代診断/検査に用いられる解析技術/ 利用される検体/バイオマーカーの種類と位置付け/予防医療、個別化医療における次世代診断/検査の位置付け第2章 次世代診断/検査の開発動向
次世代診断/検査の対象疾患・目的/疾患別の開発動向/DNAマイクロアレイを利用した診断/ 検査/リアルタイムPCRを利用した診断/検査/次世代シーケンサーの診断分野での展開/ 質量分析装置を利用した検査/リキッドバイオプシーの開発状況/血中循環腫瘍細胞(CTC)を 対象とする検査の開発状況第3章 次世代診断/検査のビジネス展開の現状と課題
次世代診断のビジネスモデルと検査の意義/価値/次世代診断・検査開発のビジネス展開/ DTC遺伝子検査のビジネス展開と動向/参入企業の動向/注目企業の動向/次世代診断・検査のための インフラビジネス/次世代診断/検査におけるバイオインフォマティクスの重要性/ ビジネス展開の際の医療環境/医療保険制度への対応/次世代診断/検査のビジネスモデル/ 次世代診断・検査の市場動向/個別市場第4章 次世代診断/検査に関する規制動向
米国における診断/検査関連の規制/欧州における診断/検査関連の規制/日本における規制動向/ 注目の規制動向/次世代診断/検査に関連する特許動向第5章 次世代診断/検査の開発企業の動向
56社の個票を掲載。掲載社名は前項「調査概要」→「調査対象」に掲載。
遺伝子検査を主に開発する企業(21社)
セルフリーDNA検査を主に開発する企業(11社)
ペプチドーム/プロテオーム検査を主に開発する企業(9社)
メタボローム検査の開発企業(7社)
マイクロバイオーム検査の開発企業(8社)
調査結果を掲載したレポートの概要
〒113-0034
東京都文京区湯島3-19-11 湯島ファーストビル 4F
TEL : 03-3835-9211(代) / FAX : 03-3831-0495
E-mail : info@seedplanning.co.jp
広報担当